محلول ها و مخلوط ها

قبل
از این که درباره محلول ها صحبت کنیم، بگذارید محلول ها را از انواع دیگر
مخلوط ها جدا کنیم. محلول ها گروهی از مولکول ها هستند که با توزیعی کاملاً
یکنواخت پخش شده اند. یک کم سخت شد، نه؟!
دانشمندان می گویند:
محلول ها سیستم های همگن هستند. حالا همگن یعنی چه؟ در انواع دیگر مخلوط
ها ممکن است یک طرف مایع مقدار زیادی از یک چیز (ماده) را در خود داشته
باشند ولی یک طرف دیگر از آن چیز کمتر داشته باشد. چنین مخلوطی همگن نیست!
اما غلظت محلول ها در تمام نقاط سیستم شان کاملاً یکسان و همگن است.
بگذارید با یک مثال موضوع را روشن کنیم:
اگر در آب شکر بریزیم، شکر
در آب حل شده و در تمام لیوان آب به طور یکنواخت پخش می شود. اما در مخلوط
آب و ماسه، ماسه به ته آب می رود و یک طرف آب بیشتر از طرف دیگرش ماسه
دارد. به همین دلیل می گوییم که شکر و آب محلول هستند ولی آب و ماسه مخلوط
هستند.
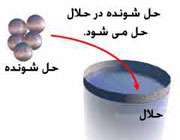
آیا هر چیزی می تواند حل بشود؟
خیلی
چیزها حل می شوند. محلول ها می توانند شامل جامداتی باشند که در مایعات حل
شده اند، یا گازهایی باشند که در آب حل شده اند (مثل آب گازدار). محلول ها
می توانند از حل شدن گازها در گازها یا مایع در مایع ها به وجود بیایند.
اگر شما بعضی چیزها را با هم ترکیب کنید و آن ها در یک توزیع یکنواخت پخش
بشوند، به آن محلول می گویند.
احتمالاً نمی توانید به راحتی کسی را
پیدا کنید که محلول جامد در جامد درست کند. اما این محلول ها وجود دارند.
آن ها اول به شکل محلول جامد یا مایع در مایع هستند ولی بعد در دمای اتاق
سخت می شوند. آلیاژهای انواع فلزات مثال های خوبی از یک محلول جامد در جامد
در دمای اتاق هستند.
پس یک محلول ساده اساساً دو ماده است که با
یکدیگر ترکیب شده اند. یکی از آن ها حل شونده نامیده می شود. حل شونده ماده
ای است که حل خواهد شد (مثل شکر) ماده دیگر حلال است، که حل کننده است
(مثل آب) اگر بخواهید تشخیص بدهید که کدام یک از دو ماده حل شونده است، به
عنوان یک قانون بدانید که معمولاً مقدار حلال از حل شونده بیشتر است.
ساختن محلول ها:
پس
چه اتفاقی می افتد؟ چطور می شود محلول ساخت؟ دو مایع را با هم مخلوط کنید و
هم بزنید. به همین سادگی! اما علم، این کار ساده را به سه مرحله تقسیم می
کند. وقتی دارید این مراحل را می خوانید به خاطر داشته باشید که (حل شونده =
شکر) (حلال = آب) - (سیستم = لیوان)
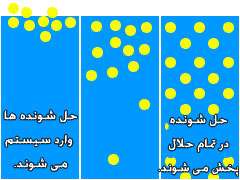
حل شونده در حلال قرار می گیرد و شروع به شکسته شدن به تکه های کوچک تر می کند.
مولکول
های حلال شروع به حرکت در همه جهات کرده و برای مولکول های حل شونده جا
باز می کنند. مثلاً مولکول های آب برای مولکول های شکر جا باز می کنند.
حل
شونده و حلال با یکدیگر برهم کنش می دهند(یعنی با هم کنش و واکنش می کنند)
تا زمانی که غلظت هر دو ماده در تمام سیستم یکسان شود. حالا باید مقدار
شکر حل شده در آب، در بالا و ته و وسط و همه جای لیوان یکسان باشد.
آیا هر چیزی می تواند محلول ها را تغییر دهد؟
البته!
هر چیزی می تواند غلظت مواد موجود در محلول را تغییر دهد. در این مورد
دانشمندان از واژه حلالیت استفاده میکنند. حلالیت توانایی یا قابلیت حلال
(مثلاً آب) برای حل کردن حل شونده (مثلاً شکر) است. ممکن است شما قبلاً اثر
دما روی حلالیت را در کلاس درستان دیده باشید. معمولاً وقتی حلال ها را
گرم می کنید، می توانند مقدار بیشتری مواد جامد را در خود حل کنند (مثلاً
شکر بیشتر ) و در عوض مقدار کمتری گاز در حلال گرم، حل می شود (مثلاً دی
اکسید کربن کمتر در نوشابه گرم) فاکتور مهم بعدی فشار است. وقتی که فشار
محیط اطراف محلول را افزایش می دهید، معمولاً مقدار بیشتری گاز در آن حل می
شود. دوباره به قوطی نوشابه تان فکر کنید. قوطی می تواند گاز را درونش نگه
دارد زیرا محتویات قوطی تحت فشار زیادی هستند. آخرین عامل مهم ساختار مواد
است. بعضی چیزها در یک نوع خاص ماده آسان تر حل می شوند. مثلاً شکر به
آسانی در آب حل می شود، اما روغن در آب حل نمی شود. پس می گوییم که آب نسبت
به روغن حلالیت کمی دارد.



















 تدریس می کنم
تدریس می کنم